学习动漫游戏专业的学生需要对电脑有一定的基础吗?学习动漫游戏专业需要有一定的计算机基础,而且基础不低,需要熟练掌握各种软件,动漫设计分为:2D动漫软件,3D动漫软件和网页动漫软
关于Q=cm△t c 的问题,进来看看吧
q=cm△t公式是什么?
Q=cm△T,该公式是计算物体吸收(放出)的热量。
物体在温度升高(或降低)时,吸收或放出热量的计算公式是Q=cm△t,当物体吸热时,物体温度升高(从t0到t),Q吸=cm(t-t0);当物体放热时,物体温度降低(从t0到t),Q放=cm(t0-t)。当吸热时,△t指的是升高的温度值;当放热时,△t指的是降低的温度值。

公式含义介绍:
Q =cm △tQ吸=cm(t-t0)Q放=cm( t0 -t )Q是热量c是物体燃烧一定质量所放的热量 单位为J/(kg0C)m是质量。
△t是温度改变值T是末温T0是初温Q=cm△t是一定质量的物质升高或降低一定的温度所吸收或放出的热量Q吸就是物体所吸收的热量Q放就是物体所放出的热量。
Q吸=cm(t2-t1)=cm△t其中,c是比热容,单位是J/kg;m是质量,单位是kg;t1、t2是初始温度和终点温度,℃。△t=t2-t1,是温度差。
对于吸热来说,就是升高了的多少度。备注:比热容,又称比热容量,简称比热,是单位质量物质的热容量,即使单位质量物体改变单位温度时的吸收或释放的内能。比热容是表示物质热性质的物理量。通常用符号c表示。
比热容公式中Q=cm△t中的Q,c,m,△t分别是什么意思
1、Q:Q是热量。
2、c:表示比热容。
3、m:表示物体的质量。
4、△t:表示物体的变化温度,即t-t0。
Q=cm△t是一定质量的物质升高或降低一定的温度所吸收或放出的热量
Q吸就是物体所吸收的热量
Q放就是物体所放出的热量
比热容的计算公式一般为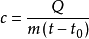
扩展资料:
比热容(Specific Heat Capacity)是指没有相变化和化学变化时,一定量均相物质温度升高1K所需的热量。
比热容越大,物体的吸热或散热能力越强。它指单位质量的某种物质升高或下降单位温度所吸收或放出的热量。
物质的比热容越大,相同质量和温升时,需要更多热能。
参考资料:比热容-百度百科
热量计算公式:Q=cm△t 其中Q,C,M,T的计算单位是什么?谢谢
Q=cm△t 式中各物理量的单位如下:
1、热量Q:焦耳( J )
2、比热容C:焦耳/千克℃ ( J/kg℃ )
3、质量m: 千克 ( kg )
4、升高(或降低)的温度△t: 摄氏度( ℃ )。

一定质量的物质,在温度升高时,所吸收的热量与该物质的质量和升高的温度乘积之比,称做这种物质的比热容(比热),用符号c表示。其国际单位制中的单位是焦耳每千克开尔文[J /(kg·K) ]或焦耳每千克每摄氏度[J /(kg·℃)]。
J是指焦耳,K是指热力学温标,即令1千克的物质的温度上升(或下降)1开尔文所需的能量。根据此定理,便可得出以下公式:
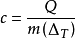
扩展资料:
比热容的单位是复合单位。
在国际单位制中,能量、功、热量的主单位统一为焦耳,温度的主单位是开尔文,因此比热容的国际单位为J/(kg·K),读作“焦[耳]每千克开[尔文]”。国际单位或为J/(kg·℃),读作“焦[耳]每千克摄氏度([]内的字可以省略。)
常用单位:J/(kg·℃)、J/(g·℃)、kJ/(kg·℃)、cal/(kg·℃)、kcal/(kg·℃)等。注意摄氏度和开尔文仅在温标表示上有所区别,在表示温差的量值意义上等价,因此这些单位中的℃和K可以任意互相替换。例如“焦每千克摄氏度”和“焦每千克开”是等价的。
参考资料:百度百科-比热容
比热容的公式Q=cm△t谁能给讲解一下
c是物质的比热容,m是物质的质量,△t是物质的温度上升了的温度,q就是热量了,一般情况下,题目如果不太难上面都会告诉你这三个量的,你带进去算一下就可以了,如果题目难就想办法转化一下,一般这种题目不会难的物理中的公式 Q=cm△t是怎样找数据
Q=释放或吸收的热量
c=比热容(题目一般会有说)
m=质量(比如XXkg啊,XXg啊,XXml啊什么的,有时候要自己算)
Δt=变化的温度(比如从20℃~100℃,它的Δt就是80℃)
燃烧、中和、金属氧化、铝热反应、较活泼的金属与酸反应、由不稳定物质变为稳定物质的反应多数化合反应是放热的(但是我们要注意高压下石墨转变成金刚石也是放热反应,尽管常压下是相反的)。
常见反应中燃烧反应、中和反应全是放热反应,酸碱中和的反应,金属与酸的反应,金属与水的反应,燃烧反应,爆炸反应全是放热反应,在具体判断中往往要结合记忆中的事实来进行。
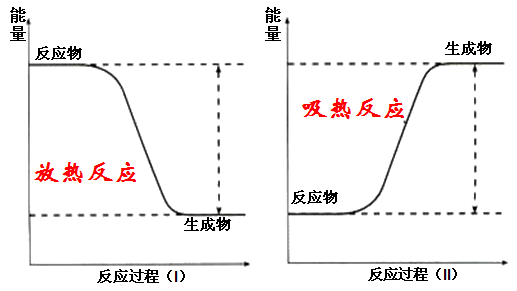
扩展资料:
不是需要加热的反应都是吸热反应,燃烧大多数要“点燃”,都是放热反应。
吸热反应就是在化学变化中,需要不断吸收大量热量的反应。
不是所有需要使用催化剂的反应都是吸热反应。C+CO2=(高温)2CO是吸热反应。
有些反应在开始时,需要提供一定的条件,如加热、点燃等,一旦反应进行开了,去掉条件反应继续进行,这样的反应是放热反应。
有时根据需要,在化学反应方程式的右侧标明是吸热还是放热,通常是+Q吸热,-Q是放热
参考资料来源:百度百科——放热反应
参考资料来源:百度百科——吸热反应
相关文章
- 详细阅读
-
软件专业主要学习什么?详细阅读

软件技术主要学什么?软件技术主要学习以下内容:1、编程语言课程(包括Microsoft公司Windows平台开发技术和SUN公司(已被甲骨文收购)的Java开发技术)2、支撑课程(如数据库技术、网
-
学习电脑技术大概要多少费用啊?详细阅读

想报一个电脑培训班要多少钱?电脑培训从3000元—30000元不等,电脑培训班要多少钱与培训课程专业和学员自身有关,主要是专业和时间。具体分析如下: 1、初级电脑培训班:初级电脑培
-
请问我在大塔儿巷老年大学电脑学习详细阅读

在培训班交了学费没有去学习,可以要求退吗?如果被拒绝怎么办正规培训学校是可以在规定时间内可退,过了视情况可以协商,能退不退可到当地劳动和社会保障局投诉。 深圳正规职业技
-
进群学习被关小黑屋了,请帮我解决一详细阅读

我被关了小黑屋,怎么办我建议你给盛大客服打个电话 不用找GM 客服就管这个事 盛大官方就有客服电话 我也遇到你说的类似的问题 就是打客服的 很管用的 客服很负责的 装备丢了
- 详细阅读
-
有没有可以查学习资料的软件,性价比详细阅读
好用的学习软件有哪些推荐几个我个人认为对学习很有帮助的app,希望对你们有一些参考价值哦。藏书馆顾名思义,藏书馆就是一个在线图书馆,目前这个App上面共有50多万本书籍可供免
-
怎样恳求医院主任给个学习机会详细阅读

医药代表怎么拜访科室主任?医药代表怎么拜访科室主任?等主任办公室没人不忙的时候,或者在早上刚上班的时候去拜访,准能见到。首次就是打个招呼,介绍一下自己和所负责的产品,对方热
- 详细阅读
-
5 G开发学习需要基础吗?详细阅读

5 G开发学习需要基础吗?当然需要了,所有的学习都需要基础,如果你没有基础你还怎么学习,这些重要的观点你还是要好好考虑一下。5 G开发学习需要基础吗?5g网络的开发学习当然是需要


